O que são Grandezas?
Grandeza pode ser definida como tudo aquilo que pode ser medido, por exemplo:
ü tempo → segundos, minutos, horas, dias, etc.
ü volume → litros, metros cúbicos, mililitros, etc.
ü massa → gramas, toneladas, quilogramas, etc.
A medida de uma grandeza é feita em comparação com uma grandeza padrão convenientemente escolhida. Desta forma, a medida de massa de um corpo é feita comparando-se a massa de um determinado corpo com a massa de um padrão adequadamente selecionado.
Dependendo da quantidade de matéria utilizamos uma determinada grandeza para medir a sua massa, por exemplo:
| Matéria | Grandeza utilizada para medir a massa |
| comprimido | mg |
| pessoa | Kg |
| automóvel | ton |
Introdução a Grandezas Químicas
Grandezas químicas estão relacionadas com massa, volume, número de átomos, número de moléculas, número de íons e, principalmente, quantidades expressas em mols. Dois importantes químicos estabelecerão leis que explicam e detalham essas relações.
ü Lei de Lavoisier ou Lei da Conservação das Massas:
Para Lavoisier (1743 - 1794), a massa antes e depois da reação permanece a mesma: "A massa total dos reagentes é igual à massa dos produtos".
Reagentes a Produtos
mR = mP
ü Lei de Proust ou Lei das Proporções Constantes:
Para Proust (1754 - 1826), uma substância pura, qualquer que seja sua origem, apresenta sempre a mesma proporção em massa. Assim, se obtendo água pura de vários locais diferentes e, por eletrólise, decompô-las e medirmos a massa dos produtos formados, notaríamos que existe uma constância entre as massas dos participantes da reação:
Tipos de grandezas existentes na Química:
ü Unidade de Massa Atômica (U)
ü Massa Atômica (MA)
ü Massa Molecular (MM)
ü Constante de Avogadro (N)
ü Quantidade de Matéria ou Quantidade em Mols (n)
E para medir a massa de um átomo ou uma molécula, qual será a grandeza utilizada?
· Unidade de Massa Atômica (U)
Átomos individuais são muito pequenos para serem vistos e muito menos pesados. Porém, é possível determinar as massas relativas de átomos diferentes, isto é, podemos determinar a massa de um átomo comparando com um átomo de outro elemento utilizado como padrão.
Em 1961, na Conferência da União Internacional de Química Pura e Aplicada (IUPAC), adotou-se como padrão de massas atômicas o isótopo 12 do elemento carbono (12C), ao qual se convencionou atribuir o valor exato de 12 unidades de massa atômica.
Uma unidade de massa atômica (1 u) corresponde desta forma a  de massa de um átomo de isótopo 12 do carbono.
de massa de um átomo de isótopo 12 do carbono. Portanto:
Obs.: O valor de 1 u é de 1,66 · 10–24 g, o que corresponde aproximada-mente à massa de um próton ou de um nêutron.
· Massa Atômica (MA)
Massa atômica é o número que indica quantas vezes a massa de um átomo de um determinado elemento é maior que 1u, ou seja, 1/12 do átomo de 12C.
Comparando-se a massa de um átomo de um determinado elemento com a unidade de massa atômica (1u), obtém-se a massa desse átomo.
Exemplo:
Quando dizemos que a massa atômica do átomo de 32S é igual a 32 u, concluímos que:
– a massa atômica de um átomo de 32S é igual a 32 u;
– a massa atômica de um átomo de 32S é igual a 32 vezes a massa de 1/12 do átomo de C-12;
– a massa de um átomo de 32S é igual a 2,7 vezes a massa de um átomo de C-12.
Massa Atômica de um Elemento
A maioria dos elementos apresenta isótopos. O cloro, por exemplo, é constituído por uma mistura de 2 isótopos de massas atômicas, respectivamente, 35 e 37.
A massa atômica do cloro é dada pela média ponderada das massas isotópicas:
Portanto:
Sendo assim, a massa atômica de um elemento hipotético A, constituído dos isótopos naturais A1, A2, ...., An, pode ser calculada por:
Exemplo:
Quando dizemos que a massa atômica do elemento cloro é 35,5 u, concluímos que:
– cada átomo do elemento cloro possui massa, em média, de 35,5 u;
– cada átomo do elemento cloro possui massa, em média, 35,5 vezes maior que  da massa do C-12.
da massa do C-12.
· Massa Molecular (MM)
Os átomos reúnem-se para formar moléculas. A massa dessas moléculas é a soma das massas atômicas dos átomos constituintes.
Como as moléculas são formadas por um grupo de átomos ligados entre si, o padrão usado como base para relacionar as massas dessas moléculas é o mesmo usado para os átomos: a unidade de massa atômica (u).
Exemplo:
C6H12O6 (C=12, H=1, O=16)
MM = 6 . 12 + 12 . 1 + 6 . 16
MM = 72 + 12 + 96
MM = 180 u
Significado:
Cada molécula de C6H12O6 possui massa de 180 u, ou seja, 180 vezes maior que 1/12 do carbono-12.
Portanto:
Massa Molecular é a soma das massas atômicas dos átomos que constituem a molécula.
ou ainda...
Vejamos outro exemplo:
Quando dizemos que a massa molecular da água H2O é 18 u, concluímos que:
• a massa de uma molécula H2O é igual a 18 u;
a massa de uma molécula H2O é 18 vezes mais pesada que 1/12 do átomo de carbono-12;
• a massa de uma molécula de água é 1,5 vezes mais pesada que um átomo de C-12.
· Constante de Avogadro (N)
Sejam as seguintes amostras: 12 g de carbono, 27 g de alumínio e 40 g de cálcio. Experimentalmente verifica-se que o número de átomos N, existentes em cada uma das amostras, é o mesmo, embora elas possuam massas diferentes. Porém, quantos átomos existem em cada uma dessas amostras? Várias experiências foram realizadas para determinar esse número conhecido como número de Avogadro (N) e o valor encontrado é igual a: 6,02.10²³
Assim, o número de Avogadro é o número de átomos em x gramas de qualquer elemento, sendo x a massa atômica do elemento, portanto existem:
• 6,02 · 1023 átomos de C em 12 g de C (MAC = 12 u);
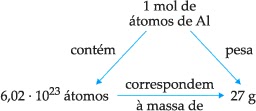
• 6,02 · 1023 átomos de Al em 27 g de Al (MAAl = 27 u);
• 6,02 · 1023 átomos de Ca em 40 g de Ca (MACa = 40 u).
· Massa Molar (M)
Massa Molar de um Elemento
A massa molar de um elemento é a massa em gramas de 1 mol de átomos, ou seja, 6,02 · 1023 átomos desse elemento. A massa molar de um elemento é numericamente igual à sua massa atômica expressa em gramas.
Exemplo:
Al (MA = 27 u)
b) NaCl (Na = 23; Cl = 35,5)
MM = 1 · 23 + 1 · 35,5
MM = 23 + 35,5 = 58,5 u
Logo, ficamos com:
· Quantidade de Matéria ou Quantidade em Mols (n)
Exemplos:
Quantos mols de átomos correspondem a 280 g de ferro? (Fe = 56 u)
Resolução:
Concluímos, portanto, que estes cálculos podem ser generalizados pela fórmula:
n= _________
m_________
massa molar
Onde temos:
• n = quantidade em mols
• m = massa em gramas
• massa molar em gramas/mol
Fonte: